全球首创!武汉理工团队成功研制可注射溶栓纳米机器人
全球首创!武汉理工团队成功研制可注射溶栓纳米机器人
近日,我校材料复合新技术国家重点实验室和材料科学与工程国际化示范学院(微电子学院)官建国教授团队在微纳机器人研究领域取得重要进展,研制出可注射溶栓纳米机器人。
研究成果以“Swarming magnetic nanorobots bio-interfaced by heparinoid-polymer brushes for in vivo safe synergistic thrombolysis”为题刊登在Science子刊《Science Advances》上,并且被《Science Advances》期刊网站首页以“Injectable nanobots deliver drugs for targeted therapies”作为Featured image加以推介。

在《Science Advances》期刊主页上
的Feature Image介绍
2021年Science期刊发布了125个新科学问题,其中在人工智能领域的第一条就提出了:可注射的抗病纳米机器人会成为现实吗?
由于人体血液循环系统几乎与所有重要组织和器官相连,开发可注射的纳米机器人进入血液系统执行药物靶向递送和心血管相关疾病治疗等任务将给生物医疗领域带来变革性新技术,具有重要学术意义和临床价值。然而,在实际应用中如何实现纳米机器人在生物介质中的有效驱动、长循环寿命、高效靶向递送和高生物安全性等问题一直严重制约它们在精准医疗方面的临床化应用。
最近,该团队通过在超顺磁纳米粒子表面修饰类肝素分子刷(PSS)开发了一种磁驱载药溶栓纳米机器人(HPB-NRs)。由于表面修饰的PSS能赋予磁性纳米粒子(MB@PSS)高的表面电荷,因而它不仅能通过静电相互作用负载溶栓药物t-PA,而且能在血液系统中实现高分散性和高血液相容性,表现出低溶血率(<5%)、强的抗生物粘附和自抗凝能力。更有意思的是,这些磁性纳米粒子还在交变磁场作用下能可逆组织成可拆解的HPB-NRs集群执行心血管疾病(血栓)的安全靶向治疗,解决传统溶栓治疗效率低、易带来出血等致命性风险。
具体治疗策略为MB@PSS纳米粒子悬浮液通过静脉注射到生物体内,然后会以单个粒子形式分散在血液循环系统中。在血栓上游通过梯度磁场将MB@PSS纳米粒子在该部位高效富集;然后在交变磁场控制下组装成HPB-NRs集群导航运动到血栓病灶部位,最后通过协同“运动靶向”给药和机械破坏进行安全高效的溶栓。体外实验和大鼠活体实验均证实,负载t-PA的HPB-NRs可以在4 h内疏通大鼠股静脉血栓;以及在完成溶栓任务后,撤除外磁场,HPB-NRs集群在血液中又可自动拆解分散成单个的MB@PSS纳米粒子,不会产生明显的器官损伤或炎症反应。
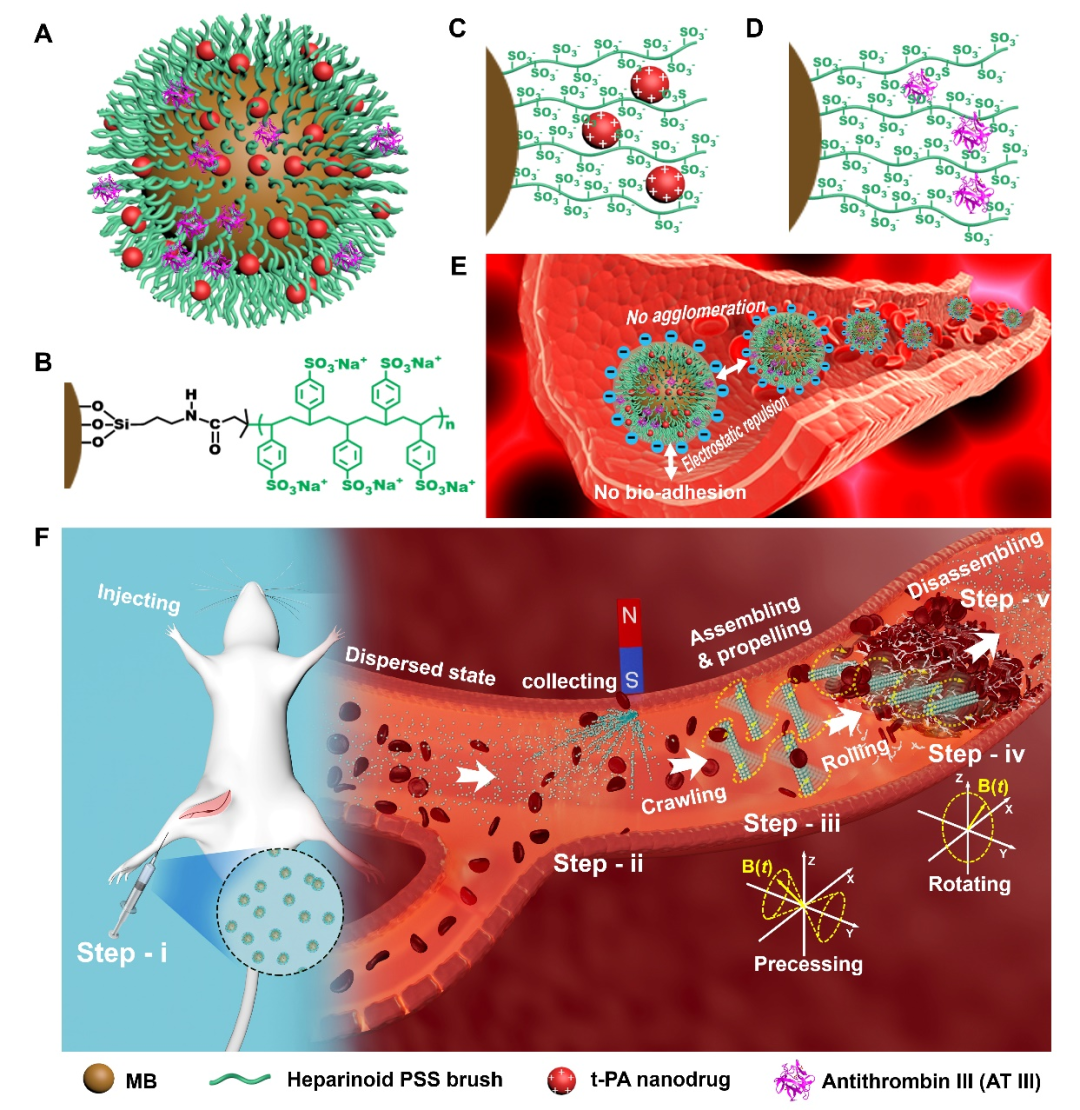
MB@PSS纳米粒子的结构和在交变磁场下组装形成HPB-NRs集群的靶向溶栓示意图
这项研究为纳米机器人在心血管疾病的安全靶向治疗方面奠定了基础,为未来治疗更具挑战性的心血管疾病,如脑卒中和肺栓塞等提供了希望;更是一个具有前瞻性的通用靶向治疗递送平台,能推动基于运动的纳米机器人在生物医学应用领域的进一步发展,为医学领域的创新开辟了一条可行的路径。
材料复合新技术国家重点实验室副主任首席教授官建国:“这就是我们研制的磁驱溶栓纳米机器人,在外磁场作用下,它可以做爬行的运动,导航到病灶部位。”
眼前,这款通过肉眼看不见的纳米量级的微小颗粒,就是可注射溶栓纳米机器人,大小相当于万分之一头发丝粗细。与带有电池、芯片等电子器件的金属盔甲式“机器人”不同,纳米机器人能将热能、磁能、电能等其他形式的能量转化为自身动能。它能够像普通药物一样,通过静脉注射方式注入体内,并执行溶栓任务,完成心血管疾病的安全靶向治疗,极大减轻病人的痛苦并降低手术风险。
材料复合新技术国家重点实验室副主任、首席教授官建国:“全世界范围内,第一次把磁驱溶栓纳米机器人做到动物体内实现安全的溶栓。在此之前,溶栓是可以解决,但会带来其他副作用,另外机器人在血管里面自身会产生第二次血栓,我们实现了拆解,工作的时候是机器人,工作完了以后,它可以自动拆解成单个的纳米粒子,不会在血管里面产生聚集凝结。”
2012年起,官建国教授团队就启动对微纳机器人的研究发展,经过十多年攻关,成功解决纳米机器人在生物介质中的有效驱动、高效靶向递送等应用难题,这将为纳米机器人在心血管疾病的安全靶向治疗方面奠定基础。
材料复合新技术国家重点实验室副主任、首席教授官建国:“这项技术目前只是在动物身上做了实验,进入临床的话还需要解决这个粒子在人体内要完全自然降解掉。未来五到十年的阶段,我们会让这个磁驱机器人真正变成具有人的智能,可以按需给药、自主寻靶,病人就可以享受到技术带来的福音了。”
武汉理工大学融媒体中心
来源:新材料研究所、长江云
我要收藏
点个赞吧
转发分享














评论排行